
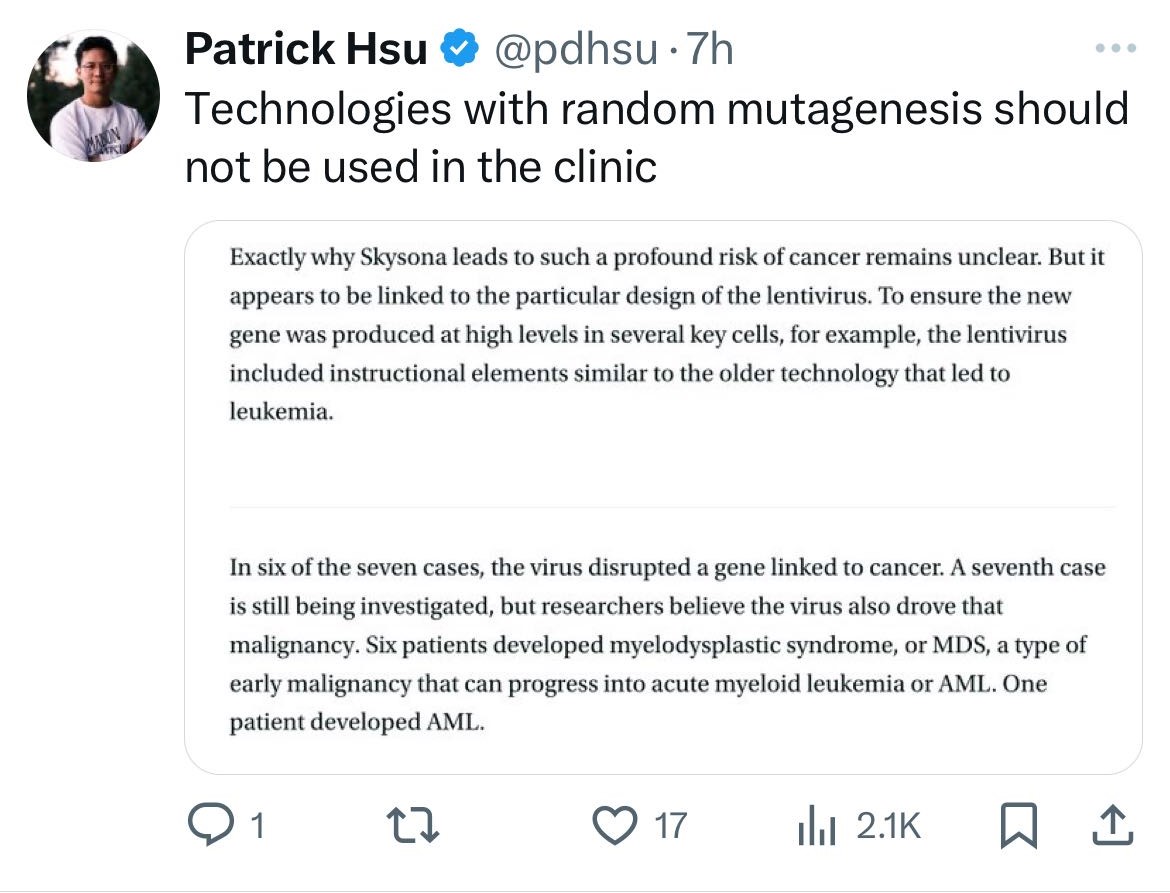
近日发表在《The New England Journal o f Medicine》的数据显示,67名患有罕见神经系统疾病的儿童接受了蓝鸟生物(Bluebird Bio)的基因疗法,其中7名儿童发展为血癌。基因疗法Skysona旨在治疗儿童脑肾上腺脑白质营养不良症(CALD),最新数据显示,自2022年6月以来又新增了4例癌症患者,其中一名患者因癌症治疗并发症不幸去世。

Skysona原本旨在减缓CALD的进展,采用的方法是通过慢病毒载体(Lenti-D)将ABCD1基因插入患者的CD34+造血干细胞中,使这些细胞能够产生对分解极长链脂肪酸至关重要的功能性ALDP蛋白。
科学家们认为,这些不良事件与Lenti-D载体的插入突变相关。该载体的整合可能会激活整合位点附近的原癌基因,例如MECOM和PRDM16,这些基因与癌症的发展密切相关。此外,一些患者体内还发现了KRAS、NRAS和WT1等基因的突变,这进一步增加了癌症的风险。
之前的研究表明,γ-逆转录病毒载体和慢病毒载体在引起插入性致癌方面的风险均较低。然而,本次临床实验证明,Lenti-D载体可能会导致克隆优势和癌症,特别是当插入发生在某些癌基因附近时。这一发现提醒研究人员在设计慢病毒载体时,在保持效率的同时要考虑降低风险,例如避免增加基因过表达的增强子元件或使用特定的基因靶向技术。
鉴于随机突变的潜在危险,领域内的领先科学家Patrick Hsu博士,发表评论,称在临床环境中应谨慎使用这类充满随机性的技术。的确,这些事件提醒我们,在推进新疗法的同时,必须重视其潜在的长期风险。
随着基因编辑技术的不断进步,碱基编辑、先导编辑和大片段插入技术eePASSIGE等新技术提供了更具针对性的基因编辑方法,而RNP复合物(Cas9蛋白+gRNA)或mRNA+gRNA的递送形式可以在避免其他外源基因的插入的同时保持较高的编辑效率。那么,是否可以利用这些更高效、更安全的编辑手段进行基因治疗?在递送载体方面,LNP近年来在递送siRNA和治疗性mRNA领域取得了重大成功和突破,加之其大规模生产的工艺已然成熟,未来是否可以考虑将LNP作为基因疗法载体开发的关键?
目前,研究人员和医疗工作者正在密切监测接受Skysona治疗的患者,未来可能会有更多病例出现。虽然有不良事件的发生,但不可否认,基因治疗对于稀有遗传疾病依旧是一个充满希望的疗法,只是未来的目标一定是要确保疗法的安全性和有效性。
参考资料:Duncan CN, Bledsoe JR, Grzywacz B, et al. Hematologic Cancer after Gene Therapy for Cerebral Adrenoleukodystrophy. N Engl J Med. 2024 Oct 10; 391 (14): 1287-1301. doi: 10.1056/NEJMoa2405541.

